硫酸 銅 五 水 和 物 水 に 溶かす
かな へん に 寿硫酸銅五水和物(化学式・構造式・頻出問題の解法など . 硫酸銅五水和物とは 硫酸銅(Ⅱ)水溶液を冷却して得られる結晶は、CuSO 4 :H 2 O=1:5の物質量比からなる。この結晶を 硫酸銅(Ⅱ)五水和物 といい、化学式は次の通りである。 [ mathrm{CuSO_{4}・5H_{2}O} ] また、硫酸銅(Ⅱ)五水和. 【高校理論化学】硫酸銅五水和物CuSO₄・5H₂Oの溶解度 . 硫酸銅五水和物CuSO₄・5H₂Oの溶解度. 2019.06.12. 検索用コード. 硫酸銅 (II)CuSO₄の溶解度は, 20℃で20g/100g水, 60℃で40g/100g水である. 以下の問いに整数値で答えよ. $CuSO₄=160, H₂O=18$ 硫酸銅 (II)五水和物CuSO₄・ {5H₂O}は, 60℃で水200gに何gまで溶けるか. 硫酸銅 (II)五水和物CuSO₄・ {5H₂O} 200gを全て溶かして60℃の飽和水溶液を 作るために必要な水は何gか. 60℃の硫酸銅 (II)CuSO₄飽和水溶液200gを20℃にまで冷却したとき, 何gの 硫酸銅 (II)五水和物CuSO₄・ {5H₂O}の結晶が析出するか. 結晶水をもつ固体(硫酸銅(Ⅱ)五水和物h₂So₄・5h₂O)の溶解の . 硫酸銅は、結晶となるときは基本的に硫酸銅五水和物となるので、周りにある水分子を取り込んで結晶となります。 図のように、 硫酸銅五水和物は水に溶けたときは結晶水を放し、溶液から結晶となるときは水を取り込む、という性質を持って. 硫酸銅五水和物など水和物の濃度問題の解法! に着目! | 化学 . 硫酸銅五水和物を含む水和物の濃度問題って結構悩むと思います。ですが、俺の提唱する『あるもの』を「ある覚え方」 をするだけで楽勝で攻略できます。この無水物の濃度問題が出来ないのは、ほぼ間違いなく、この覚え方に着目できて. 至急お願いします!!硫酸銅五水和物の問題です。.CuSO4の水 . 硫酸銅五水和物の問題です。 .CuSO4の水に対する溶解度は60Cで40、20Cで20で ある。 60Cの飽和水溶液140gを20Cに冷却したとき、 CuSO4・5H20は何g析出するか。 式量はCUSO4=160、 H20=18、CuSO4・5H20=250とし、小数第1位を四捨 五入して整数値で答えよ。 以下の画像が模範解答なのですが、、、 僕は析出量を考えて、 20/140=160/250x/140としました。 (飽和水溶液140gを60℃から20℃に下げた時の硫酸銅の析出量)なぜ、これで出来ないのでしょうか、、、 合っている気がしてしまうのですが 宜しくお願い致します!. 硫酸銅(II)五水和物を水に溶かした場合 - 教えて!goo. 硫酸銅(II)五水和物CuSO4・5H2Oは水にはよく溶けますが、この固体粉末を水に溶かしたときは、イオン反応式でかくと、どういう反応が具体的に起こっているのでしょうか?もともと水和物という水と仲. - 化学 解決済 | 教えて. 硫酸銅(II) - Wikipedia. 水和物として、有名な青色の三斜晶系結晶(五水和物)の他に、一水和物、三水和物があり、水に易溶で水溶液は青色を示す。 中学校 および 高校 の 理科 の実験に用いられることから馴染み深い化合物である。. 【高校化学】「硫酸銅」 | 映像授業のTry IT (トライイット). 硫酸銅CuSO 4 に水を加えると、 硫酸銅五水和物CuSO 4 ・5H 2 O ができます。 水和物とは、物質に水和水がくっついたものでしたね。 これに関して、みなさんに注目してほしいのは、色の変化です。 CuSO 4 は、 白色 の粉末です。 CuSO 4 ・5H 2 O は、 青色 の物質です。 ちなみに、この変化は、水の検出方法にも利用されています。 硫酸銅に限らず、無機物質については、色の変化に要注意です。 この授業の先生. 五十嵐 健悟 先生. 「目に見えない原子や分子をいかにリアルに想像してもらうか」にこだわり、身近な事例の写真や例え話を用いて授業を展開。 テストによく出るポイントと覚え方のコツを丁寧におさえていく。 硫酸銅. 25. 友達にシェアしよう!. 【高校化学】「水和物の再結晶」 | 映像授業のTry IT (トライイット). この物質を、 硫酸銅五水和物 といいます。 この物質のように、ある物質に水分子が結合した物質を 水和物 と呼びます。 さらに、結合した水分子のことを、 水和水 といいます。 水和物の再結晶では、溶媒の水も析出する. では、水和物の再結晶に関する問題を解いてみましょう。 まずは、問題の意味を理解します。 硫酸銅水溶液を冷やし、再結晶を行いました。 すると、析出したのは、硫酸銅ではなく、 硫酸銅五水和物 の結晶だったのです。 これまでの再結晶の計算では、溶質だけが結晶になっていました。 しかし、今回は、 溶媒である水までも結晶として析出する わけです。 この点に注目しながら、問題を解いていきましょう。 水和物の再結晶では、溶液・溶質の量の変化に注目. 考え方は、これまでの再結晶の問題と同じです。. 硫酸銅 実験 加熱 五水和物 計算 高校化学 エンジョイ . - YouTube. 硫酸銅 実験 加熱 五水和物 計算 高校化学 エンジョイケミストリー 114103 - YouTube. 0:00 / 14:40. 硫酸銅 実験 加熱 五水和物 計算 高校化学 エンジョイケミストリー 114103. ヒロシのエンジョイケミストリー. 9.95K subscribers. Subscribed. 
イオン 導出 と は- Yahoo!知恵袋. む くり 鮒
更年期 匂い に 過敏モル濃度の計算について。 硫酸銅五水和物(CuSO4・5H20)から0.01MのCuSO4水溶液を50mL調製したいです。水和物の場合の計算方法がわからないので教えていただきたいです。 何を求める問題なのでしょうか硫酸銅が5.0×10の-4乗mol必要なので硫酸銅五水和物ももちろん5.0×10の-4乗必要です余計な水が付い . 理科質問 硫酸銅五水和物を溶かす - YouTube. いまちゅう先生のすべての授業はこちらww.imachu-juku.com/ij/entry7.html高校数学も一緒に勉強したい場合はこちらから . 高校化学の質問です水和物は水に溶かすと、水和物中に含まれていた水の分子は水. - Yahoo!知恵袋. 例えば、硫酸五水和物を100gの水に溶かすとして、「溶媒の値」はもとの水100gか、100g+、水和物が溶けて生じた水のgか、どちらでしょうか? . わかる方は回答をお願いします。 ちなみに高1の問題です。 硫酸銅(Ⅱ)五水和物CUSO4・5H2O 12.5gに水を加えて、500gの . 硫酸銅(Ⅱ)五水和物50gを、60℃の水100gに溶かした水溶液. - Yahoo!知恵袋. 化学. (1) 硫酸銅 (II)五水和物50gを水に溶かして、60℃の飽和水溶液を作るには、水を何g 加えればよいか。. ただし、60℃の飽和水溶液100g中における硫酸銅 (II)無水物の質量は28gとする。. (2) 硫酸銅 (II)無水物の20℃の水に対する溶解度は20である。. この飽和 . 硫酸銅(Ⅱ)五水和物25gを100gの水に溶かすと、何%の硫酸銅(Ⅱ)水溶液に. - Yahoo!知恵袋. 硫酸銅(Ⅱ)五水和物25gを100gの水に溶かすと、何%の硫酸銅(Ⅱ)水溶液になるか。ただし、原子量はCu=64、S=32、O=16、H=1とする。 以下のようになります(画像添付)。 . 硫酸銅(Ⅱ)五水和物25gを100gの水に溶かすと、何%の硫酸銅(Ⅱ)水溶液になるか。 . 硫酸銅を溶かす方法 科学人気のマルチメディア・ポータル. 2024. 硫酸銅 (II)五水和物CuSO₄・ {5H₂O} 200gを全て溶かして60℃の飽和水溶液を 作るために必要な水は何gか. 60℃の硫酸銅 (II)CuSO₄飽和水溶液200gを20℃にまで冷却したとき, 何gの 硫酸銅 (II)五水和物CuSO₄・ {5H₂O}の結晶が析出するか. メスフラスコの標線の合わせ方 -水に溶かした硫酸銅(Ii)五水和物に塩化ア- | Okwave. 水に溶かした硫酸銅(II)五水和物に塩化アンモニウム5 mLと濃アンモニア水2.5 mLを少しだけ加えたものをメスフラスコの標線に合わせるように蒸留水を注入する際、一度 メスフラスコの標線まで蒸留水を加えた後、さらに静かに振って、再度標線に合わせるというテキストのやり方を行いました。. 硫酸銅(りゅうさんどう)とは? 意味や使い方 - コトバンク. 銅の硫酸塩。 1 硫酸銅(Ⅱ)。 無水和物は白色の粉末。 水を吸収して五水和物になりやすい。五水和物は青色の結晶で、 胆礬 たんばん ともいい、酸化銅を希硫酸に溶かして作る。 ボルドー液・青色顔料・防腐剤など用途が広い。 化学式CuSO 4 2 硫酸銅(Ⅰ)。 白色の粉末。. PDF 硫酸銅五水和物の熱分解過程. 
タロット どう 思 われ てる[化学]硫酸銅(∥)五水和物CuSO4・5H2O25.0gを水に溶かし. - Yahoo!知恵袋. [化学] 硫酸銅(∥)五水和物CuSO4・5H2O 25.0gを水に溶かして、500mlの水溶液を調製した。この硫酸銅(∥)CuSO4水溶液の、モル濃度はいくらか。 また質量パーセント濃度はいくらか。ただし、溶液の密度は1.00g/cm^3 とする。 解法を教えてください。. 水和物は溶媒に含まれますか?例えば、硫酸五水和物を100gの水に溶かすとして、. - Yahoo!知恵袋. 硫酸銅(II)五水和物は、20度の水200gに何g溶けるか。 ただし硫酸銅(II)は20度の水100gに20g溶けるものとする。 この問題の解き方がわかりません! 同じ問題の知恵袋に載っているものを見ても途中式が分からず結局理解できません。. 水に溶かすと電気が流れる物質・流れない物質【電解質】 | 理科の授業をふりかえる. プールの中には塩素などの消毒用の物質が溶け込んでいます。. ただの水は電流を流しませんが、 塩素が入っていると水に電気が流れるようになるんです。. 実験して確かめてみましょう!. 水に電気が流れるか調べるために 精製水 (超純水などとも呼ば . 硫酸銅五水和物を水に溶かし10%の硫酸銅水溶液を200g作りま. - Yahoo!知恵袋. 硫酸銅五水和物を水に溶かし10%の硫酸銅水溶液を200g作ります。 この時必要な硫酸銅五水和物の量を求めたいのですが、結晶水を考慮して計算した場合どのように求めれば良いのでしょうか。 cuso₄・5h₂. 硫酸銅と硫酸銅(Ⅱ)無水物と硫酸銅(Ⅱ)五水和物の違いって何でしょうか? - Clearnote. 硫酸銅(Ⅱ)五水和物とは、1molの硫酸銅(Ⅱ)に対して5molの水が結合したものです。 硫酸銅(Ⅱ)無水物とは、水が結合していない硫酸銅(Ⅱ)のことです。 硫酸銅と書かれていたら、硫酸銅(Ⅱ)無水物のことを考えればよいと思います。 ちなみに、乾燥した硫酸銅(CuSO4)は白い粉末ですが、水に . 硫酸銅五水和物を水に溶かしたものに、シュウ酸カリウム一水和物を水に溶かしたも. - Yahoo!知恵袋. 1 回答. 硫酸銅五水和物を水に溶かしたものに、シュウ酸カリウム一水和物を水に溶かしたものをかき混ぜながら加えると淡青色沈澱ができると聞いたのですが、反応式がどうなるのかわかりません。. また、このあとデカンテーションで上澄み液を別の容器 . 【高校化学】「水和水を含む結晶・質量モル濃度」(練習編) | 映像授業のTry IT (トライイット). 赤本 昔 の
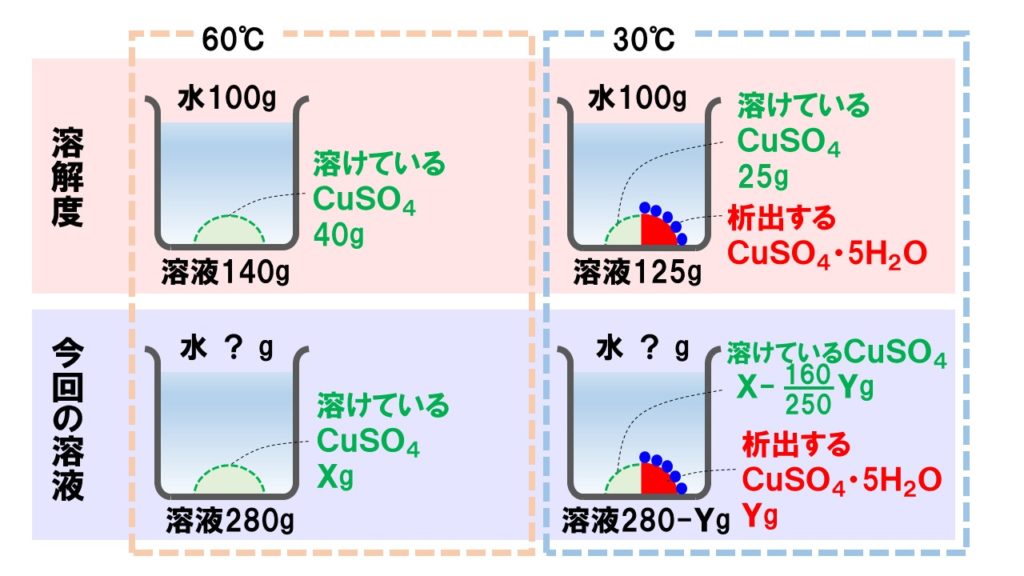
apple watch 腕 につけ ないまず、60℃の飽和水溶液に溶けている硫酸銅の質量を求めます。 60℃での硫酸銅の溶解度は40です。 つまり、140gの硫酸銅水溶液には、40gの硫酸銅が溶けていることになります。 このことから、420g中に溶けている硫酸銅は、次の通りです。 420g×40g/140g=120g. 硫酸銅は水に溶けやすいですよね? - 解けるときの化学反応式、教. - Yahoo!知恵袋. 硫酸銅は水に溶けやすいですよね? 解けるときの化学反応式、教えてください。 . 硫酸銅五水和物を加熱すると、なぜ色が変化するのか。 . 高校化学の質問です 水和物は水に溶かすと、水和物中に含まれていた水の分子は水和物から離れていくの . 化学講座 第45回:固体の溶解度(水和水あり) | 私立・国公立大学医学部に入ろう!ドットコム. 水和物を水に溶かす問題を考える場合、水和物の中に含まれている溶質と、 (これは溶媒と考える)を分けて考えなくてはいけません。 例えば、 を200g溶かす場合を考えてみましょう。 の式量は250ですね。このうち は160、 は18×5=90を占めています。. 水和物水溶液のモル濃度の問題が分かりません。わかる方は回答をお願い. - Yahoo!知恵袋. ちなみに高1の問題です。 硫酸銅(Ⅱ)五水和物CUSO4・5H2O12.5gに水を加えて、500gの硫酸銅(Ⅱ)水溶液を作った。 . 25°Cにおける水100gに溶かすことができる無水物CuSO4の質量が22g 飽和溶液の密度1150g/L でお願いします。 . 硫酸銅五水和物10gを100gの水に溶解した。 . すいませんだれか至急でこの問題解いてください!硫酸銅五水和物CuS. - Yahoo!知恵袋. 1 回答. 大納言 殿 参り た まひ て 現代 語 訳
研究 の 背景 書き方すいませんだれか至急でこの問題解いてください!. 硫酸銅五水和物CuSo4•5H2Oの結晶10gを水100gに溶かした。. ただしCuSo4=160、H2O=18とする。. ⑴溶液中の溶質は何gか ⑵溶液中の溶媒は何gか ⑶溶液の質量パーセント濃度は何%か. 化学 ・ 642 閲覧. 理論化学「水和物の再結晶」析出する硫酸銅(Ⅱ)五水和物の量の求め方 | Tekibo. 硫酸銅(Ⅱ)五水和物cuso 4 ・5h 2 oは、硫酸銅(Ⅱ)cuso 4 の無水物に水分子h 2 oが5分子くっついたものです。 水に溶けると、この5h 2 o部分は溶媒の水と一緒になってしまいます が、 結晶として析出する場合には5分子の水もくっついて析出 します。. 水和とはどのような現象かわかりやすく解説してみた | 化学受験テクニック塾. 水和とはどのような現象なのかを詳しくわかりやすくまとめました。水和ってなんとなく理解しているけど、深く理解していない人が多い分野だと思われます。また、水和という言葉は硫酸銅五水和物で学んだ人も多いと思います。この辺りの「水和物」についても解説していきます。. 化学のppm計算を教えてください。硫酸銅5水和物を0.5055gとり、1. - Yahoo!知恵袋. 2013/12/14 14:21. 1 回答. スケベな娘の落とし方 ドスケベなおばさんがシコんであげる
痰 に 血 が 混じる 鼻化学のppm計算を教えてください。. 硫酸銅5水和物を0.5055gとり、100mlの水に溶かすと0.02024mol/l の溶液が出来た。. 銅の原子量を63.54とするとき、銅のppm (mg/l)を求めよ。. また、この溶液 を正確に5mlとって50mlの溶液に希釈したときの銅のppm . 硫酸銅(Ⅱ)五水和物CuSO4・5H2Oの結晶11.1gを100gの水に溶かす. 
喉仏 の 横 が 痛い硫酸銅五水和物飽和溶液の体積モル濃度と質量モル濃度の出し方を教えてください。 25°Cにおける水100gに溶かすことができる無水物CuSO4の質量が22g 飽和溶液の密度1150g/L でお願いします。. 硫酸銅5水和物25.0gを水に完全に溶かし500gとした溶液の質量モル濃度の. - Yahoo!知恵袋. ファンクション ポイント 法 の 説明 は どれ か
3089 レ 時刻硫酸銅5水和物25.0gを水に完全に溶かし500gとした溶液の質量モル濃度の求め方を教えてください 硫酸銅(Ⅱ)五水和物の式量を250、硫酸銅(Ⅱ)の式量を160とします。質量モル濃度は溶媒1kgあたりの物質量で表. Yahoo!知恵袋 . 濃度計算を極めるための3問の解説(これらの問題を自力で解くことができれば、濃度計算はマスターしたと言えます!)【化学計算の王道】. ただし硫酸銅の式量は160で水の分子量は18とします。 硫酸銅の性質. まずは硫酸銅の性質を簡単に説明します。 硫酸銅は水に溶けて溶液中で溶質となっているときはCuSO 4 ですが、水から結晶として取り出した場合は硫酸銅五水和物となっています。. 硫酸 - Wikipedia. 硫酸を水に溶かすと発熱するが、氷と混ぜると多くの水溶性化合物に見られるように、逆に寒剤ともなり得る。 金属に対する反応 [ 編集 ] 金属と反応させた場合の挙動は、金属の種類のほか、硫酸の濃度と温度に依存する。. 下駄 どこで 買う
霧 降 の 滝 駐 車場硫酸銅と硝酸銀の製法・性質・用途とは? わかりやすく解説!. 硝酸銀は、写真のフイルムや印画紙の感光材料の製造にたくさん使われるほか、銀めっき液や、銀鏡の製造などに使われています。. 硫酸銅には硫酸第一銅と硫酸第二銅とがありますがふつう硫酸銅といえば、硫酸第二銅の五水和物CuSO4・5H2Oをさします . 溶解度の問題で・・・ -CuSO4・5H2O(硫酸銅II五水和物)が水10- | OKWAVE. 硫酸銅(II)(式量160)の溶解度は60°Cで40, 20°Cで20である。60°Cで水100gに溶かすことのできる硫酸銅(II)五水和物は何gか。また、このようにしてつくった飽和水溶液を20°Cまで冷却した場合、析出する硫酸銅五水和物の結晶は何gか。ただし、H2Oの式量を18とする。. 硫酸銅 - Wikipedia. 硫酸銅. 硫酸銅 (りゅうさんどう、Copper sulfate)は、 銅 の 硫酸塩 である。. 組成の違いにより、 硫酸銅 (I) (Cu 2 SO 4 )と 硫酸銅 (II) (CuSO 4 )がある。. 通常、『硫酸銅』というと、 硫酸銅 (II)五水和物 (CuSO 4 ・5H 2 O)を指す。. 硫酸銅 (I) 硫酸銅 (II)五 . 水和物 - Wikipedia. 水和物の化学的性質. 水和水は加熱すると失われるが、100 °C以上での加熱を必要とするものもある。. 加熱の程度によって様々な割合の水和物の生じる化合物もある。. 炭酸ナトリウム 十水和物のように、自らの結晶水に溶ける化合物もある。. 水和物を持つ . 化学の水和物の質問:硫酸銅(Ii)の溶解度と析出量について| Okwave. 硫酸銅(II)(式量160)の溶解度は60°Cで40, 20°Cで20である。60°Cで水100gに溶かすことのできる硫酸銅(II)五水和物は何gか。また、このようにしてつくった飽和水溶液を20°Cまで冷却した場合、析出する硫酸銅五水和物の結晶は何gか。ただし、H2Oの式量を18とする。. にんにく の 口臭 を 消す 方法
20℃で水100gに硫酸銅(Ⅱ)五水和物を何g溶かすと飽和水溶液にな. - Yahoo!知恵袋. 20℃で水100gに硫酸銅(Ⅱ)五水和物を何g溶かすと飽和水溶液になるか。 ただし、20℃で硫酸銅(Ⅱ)五水和物の溶解度は20.2g/100g . 【至急】高校化学 - 硫酸銅(Ⅱ)五水和物CuSO₄・5H₂Oの48℃. - Yahoo!知恵袋. 硫酸銅五水和物 CuSO₄・5H₂0 の結晶 50gをすべて溶かすために,60°Cの水を何g加えたらよいか。 A.62g (1)は、硝酸カリウムの18°Cの溶解度は,30である。 質量パーセント濃度10%の硝酸カリウム水溶液100gに,18°Cでさらに何gの硝酸カリウムが溶けるか。